חמצן הוא ... נוסחת החמצן. מולקולת חמצן
בין כל החומרים על כדור הארץ, מקום מיוחד הוא תפוס על ידימה שהחיים מספקים הוא חמצן. זה נוכחותו שהופכת את הפלנטה שלנו ייחודית בין כל האחרים, מיוחד. בזכות החומר הזה, יש כל כך הרבה יצורים יפים בעולם: צמחים, בעלי חיים, אנשים. חמצן הוא תרכובת חיונית, ייחודית וחשובה ביותר. לכן, לנסות לגלות מה זה, מה המאפיינים אותו.

יסוד חמצן כימי: אופייני
ראשית, אנו מאפיינים את מיקומו של אלמנט זה בטבלה המחזורית. זה יכול להיעשות על ידי מספר פריטים.
- המספר הסידורי הוא 8.
- המסה האטומית היא 15.99903.
- הוא ממוקם בקבוצה השישית של תת הקבוצה העיקרית של התקופה השנייה של המערכת.
- המטען של הגרעין הוא +8, מספר הפרוטונים הוא 8, מספר האלקטרונים הוא 8, מספר הנייטרונים הוא 8. לכן, מספר קסמים כפול מתקבל, שבגללו נמדדת יציבות הצורה האיזוטופית העיקרית 16O.
- השם הלטיני של האלמנט הוא חמצן. רוסית - חמצן, שם זה נוצר מן הביטוי "הלידה חומצות." יש גם שם נרדף, לפעמים זה נקרא חמצן.
יש להקדיש תשומת לב מיוחדת לניתוח המבנה האלקטרוני של האטום, שכן הוא מסביר את יציבות המולקולה ואת התכונות הפיסיקליות והכימיות שהוצגו.
מבנה המולקולה
התצורה האלקטרונית של האטום מיוצגת על ידי הנוסחה 1s22s22p4. מתוך רשומה זו ברור כי לפני השלמת רמת האנרגיה ויצירת ברית octet, חמצן חסר שני אלקטרונים. זה מסביר את המאפיינים הבאים:
- מולקולת החמצן היא דיאטומית;
- מידת החמצון של האלמנט היא תמיד -2 (למעט חמצן וחמצן פלואור, שבו הוא משתנה ב -1 ו -2 בהתאמה);
- הוא החמצון החזק ביותר;
- קל להגיב אפילו בתנאים רגילים;
- הוא מסוגל להרכיב תרכובות נפץ.
עכשיו לשקול את השאלה של המבנה. כיצד נוצרת מולקולת חמצן? ראשית, מנגנון היווצרות הוא קונוולנטי nonpolar, כלומר, בשל סוציאליזציה של האלקטרונים של כל אטום. לפיכך, הקשר הוא גם לא פולני קוולנטי. במקרה זה, הוא כפול, שכן כל אחד האטומים יש שני אלקטרונים לא מזוהרים ברמה החיצונית. אתה יכול פשוט מאוד לראות איך חמצן נראה. הנוסחה היא כדלקמן: О2 או O = O.
בשל נוכחות של קשר כזה, המולקולה יציבה מאוד. עבור תגובות רבות המעורבות בה, נדרשים תנאים מיוחדים: לחץ מוגבר, חימום, שימוש זרזים.
כמו יסוד כימי, חמצן הוא אטום,שבו יש שלושה איזוטופים הקיימים ביציבות בטבע. המספרים שלהם הם בהתאמה 16, 17, 18. עם זאת, יחס האחוז שונה מאוד, מאז 16כ -99.759%, והשאר פחות מ -0.5%. לכן, האיזוטופ הנפוץ והיציב ביותר הוא בדיוק עם מספר המוני של 16.

חומר פשוט חמצן
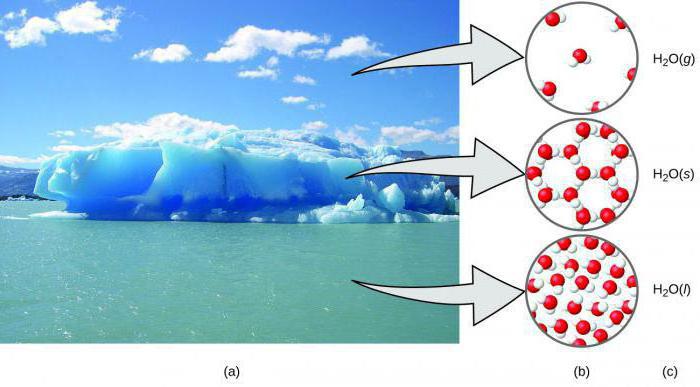
אם אנחנו מדברים על אלמנט זה כפשוטחיבור, ואז מיד להצביע על מצרף המדינה בתנאים רגילים. חמצן הוא גז שאין לו טעם, צבע או ריח. מולקולה דיאטומית, שהיא החומר השופע ביותר על פני כדור הארץ, לאחר מימן וגז אצילי של הליום.
ישנם מצבים מצטברים אחרים של חומר זה. אז, בטמפרטורה שלילית של -1830C חמצן מתעבה לתוך נוזל כחול יפה. אם אתה חורג מהסף של -2000C, הנוזל יהיה לגדול לתוך גבישים כחולים בהירים של צורה דמוית מחט דמוית מונו.
ישנם שלושה סוגים עיקריים של הקיום של חמצן במצב מוצק.
- אלפא טופס (α-O2). יש טמפרטורה מתחת ל 200 0C
- טופס בטא (β-O2). מרווח טמפרטורה -200-4000C
- טופס גמא (γ-O2). מרווח מ -400 ל -5000C
חמצן הוא אחד החשובים והמשמעותיים ביותרגזים. לא רק על החיים של יצורים חיים על הפלנטה, אלא על הטבע כולו. קשה לנקוב במינרל או במתחם טבעי, שבו הוא לא ייכלל כאלמנט.
היסטוריה של גילוי
האזכור הראשון זה באוויריש סוג של גז התומך תהליכי בעירה, הופיע במאה השמיני. עם זאת, אז כדי ללמוד את זה, כדי להוכיח קיום ופתח לא היתה אפשרות טכנית. רק אחרי כמעט אלף שנה, במאה ה -18 זה נעשה, בזכות עבודתם של כמה מדענים.
- 1771 קרל Scheele הניסויים הניסויים הניסויים של הרכב ומצא כי שני הגזים העיקריים הם חמצן וחנקן.
- פייר ביין מקיים ניסויים על פירוק כספית ותחמוצת שלה רשמית רשומות התוצאות.
- 1773 Shelele פותחת רשמית את אלמנט החמצן, אך אינה מקבלת אותו בצורתו הטהורה.
- 1774 אלוהים פריסטלי התחשבות Scheele שהופך אותו, כפי שהוא פותח, ומקבל את פירוק החמצן הטהור של תחמוצת כספית.
- 1775 אנטואן Lavoisier נותן את השם אלמנט זה ויוצר תורת הבעירה כי קיים במשך יותר ממאה שנים.
- 1898 תומפסון עושה את החברה לחשוב כי החמצן של האוויר יכול להסתיים בגלל פליטות פחמן דו חמצני גדול לתוך האטמוספרה.
- באותה שנה Timiryazev מוכיח את ההפך, שכן הוא מסביר כי הספק של החמצן הוא צמחים ירוקים של כדור הארץ.
לפיכך, נודע כימייצג חמצן, שהוא חשוב ומשמעותי עבור החיים הוא גז. לאחר שכל התכונות הפיסיקליות והכימיות של החומר נחקרו, שיטות ההכנה שלו נחשבו, התוכן המשוער במים, קרום כדור הארץ, האטמוספירה ומקומות אחרים של כדור הארץ חושבו.

תכונות פיסיקליות
אנו נותנים את הפרמטרים הפיזיים העיקריים שבאמצעותם מתחם זה יכול להיות מאופיין.
- חמצן הוא גז בתנאים רגילים, להיות חלק בלתי נפרד מהאוויר (21%). אין לו צבע, טעם וריח. קל יותר מהאוויר, מסיס היטב במים.
- הוא נספג באופן פעיל על ידי אבקות פחם ואבקת מתכת, הוא מתמוסס בחומרים אורגניים.
- נקודת הרתיחה היא -1830C
- התכה - 218.350C
- הצפיפות היא 0.0014 g / cm3.
- קריסטל הסריג הוא מולקולרי.
חמצן יש תכונות פרמגנטיות במצב נוזלי.
תכונות כימיות
כמה פעיל הגז המדובר, איךהוא מתנהג עם תגובות עם חומרים אחרים, כימיה מספרת בפירוט. חמצן הוא מסוגל להציג כמה דרגות של חמצון, אם כי הנפוץ ביותר הוא -2, אשר נחשב קבוע. בנוסף, קיימים תרכובות שבהן הערכים הינם כדלקמן:
- ובלים
- -0.5;
- -1/3;
- +0.5;
- +1;
- +2
הפעילות הכימית מוסברת בשיאזיקה האלקטרון, שכן הערך של electronegativity על פי סקר הוא 3.44. גבוה רק פלואוריד (4). לכן, חמצן הוא חזק מאוד oxidant. במקביל, בתגובות עם חמצון אפילו יותר חזק מתנהג כמו סוכן הפחתת, המציג מצב חמצון חיובי. לדוגמה, תחמוצת פלואוריד O+2 F2- .

יש מספר עצום של תרכובות, הכוללות חמצן. אלה הם סוגי החומרים, כגון:
- תחמוצות;
- תחמוצות;
- ozonides;
- סופר-אוקסידים;
- חומצות;
- בסיסים;
- מלחים;
- מולקולות אורגניות.
עם כל האלמנטים, חמצן הוא מסוגל להיכנסתגובה בתנאים רגילים, למעט מתכות אצילות, הליום, ניאון וארגון הלוגנים. עם גזים אינרטי, זה לא אינטראקציה בכל תנאי.
השגת בתעשייה
תכולת החמצן באוויר ובמים כה גדולה (21 ו -88% בהתאמה), שהשיטה התעשייתית העיקרית של הסינתזה שלה היא זיקוק חלקי של אוויר נוזלי ואלקטרוליזה של מים.
השיטה הראשונה משמשת לעתים קרובות במיוחד. אחרי הכל, הרבה גז זה יכול להיות מבודד מן האוויר. עם זאת, הוא לא יהיה נקי לחלוטין. אם יש צורך במוצר באיכות גבוהה יותר, אז תהליכים אלקטרוליזה מתחילים. חומר הגלם עבור זה הוא מים או אלקלי. נתרן או אשלגן הידרוקסיד משמש להגברת המוליכות החשמלית של הפתרון. באופן כללי, המהות של התהליך מצטמצם פירוק של מים.

נכנסים למעבדה
בין שיטות המעבדה, השיטה של טיפול בחום הפכה נפוצה:
- תחמוצות;
- מלחים של חומצות המכילות חמצן.
בטמפרטורות גבוהות הם מתפרקיםשחרור של חמצן גזי. התהליך הוא מזרז לרוב על ידי תחמוצת מנגן (IV). החמצן נאסף על ידי עקירה של מים, והוא נמצא החוצה - על ידי קרן עשן. כידוע לך, באווירה של חמצן, הלהבה מתלקחת מאוד.
חומר נוסף המשמש לייצורחמצן בשיעורי הכימיה בבית הספר, מי חמצן. גם פתרון 3% תחת השפעת הזרז מיד decomposes עם שחרורו של גז טהור. זה רק צריך להיות שנאסף. הזרז הוא זהה - MnO תחמוצת מנגן2.
בין המלחים הנפוצים ביותר הם:
- מלחיות bertholets, או אשלגן כלור;
- אשלגן permanganate, או מנגן.
כדי לתאר את התהליך, אנו יכולים לתת את המשוואה. חמצן מספיק לצרכים מעבדה ומחקר:
2KClO3 = 2KCl + 3O2↑.
Allotropic שינויים של חמצן
יש שינוי allotropic אחד כי יש חמצן. הנוסחה למתחם זה היא O3, זה נקרא אוזון. זהו גז שנוצר בתנאים טבעיים בהשפעת הפרשות אולטרה סגול וברקים על חמצן האוויר. בניגוד O עצמה2, האוזון יש ריח נעים של רעננות, אשר מורגש באוויר לאחר הגשם עם ברקים ורעמים.
ההבדל בין חמצן לאוזון הוא לא רק מספר האטומים במולקולה, אלא גם במבנה של סריג הבדולח. מבחינה כימית, האוזון הוא מחמצן חזק עוד יותר.
חמצן הוא מרכיב של אוויר
התפלגות החמצן בטבע היא רחבה מאוד. החמצן נמצא ב:
- אבנים ומינרלים;
- מים מלוחים ורעננים;
- אדמה;
- אורגניזמים של צמחים ובעלי חיים;
- אוויר, כולל האטמוספירה העליונה.
ברור, כל פגזי כדור הארץ נכבשים על ידי זה -ליטוספירה, הידרוספרה, אווירה וביוספרה. חשוב במיוחד הוא התוכן שלה באוויר. אחרי הכל, זה גורם זה מאפשר צורות חיים, כולל האדם, להתקיים על הפלנטה שלנו.

הרכב האוויר שאנו נושמים הוא הטרוגני ביותר. הוא כולל גם רכיבים קבועים ומשתנים. ללא שינוי ותמיד נוכחים:
- פחמן דו חמצני;
- חמצן;
- חנקן;
- גזים אצילים.
המשתנים כוללים אדי מים, חלקיקי אבק, גזים חיצוניים (פליטה, מוצרים בעירה, נרקבים וכו '), אבקת צמחים, חיידקים, פטריות ועוד.
חשיבות החמצן בטבע
זה מאוד חשוב כמה חמצן הוא הכילטבע. זה ידוע כי על כמה לוויינים של כוכבי לכת גדולים (צדק, שבתאי) כמויות זעירות של גז זה נמצאו, אבל אין חיים ברורים שם. לכדור הארץ שלנו יש כמות מספקת של מים, אשר בשילוב עם מים מאפשרים להתקיים לכל אורגניזמים חיים.
בנוסף להיותו משתתף פעיל בנשימה, החמצן עדיין מבצע אינספור תגובות חמצון, אשר משחררות אנרגיה לכל החיים.
הספקים העיקריים של גז ייחודי זה הםהטבע הם צמחים ירוקים וכמה סוגים של חיידקים. הודות להם, נשמרת איזון קבוע של חמצן ופחמן דו חמצני. בנוסף, אוזון בונה מגן מגן על פני כדור הארץ כולו, אשר אינו מאפשר חדירה של כמויות גדולות של קרינה אולטרה סגולה כי הורסת אותו.

רק סוגים מסוימים של אורגניזמים אנאירוביים (חיידקים, פטריות) מסוגלים לחיות מחוץ לאווירת החמצן. עם זאת, יש הרבה פחות מהם מאשר מי צריך את זה מאוד.
שימוש בחמצן ואוזון בתעשייה
תחומי השימוש העיקריים של שינויים חמצן allotropic בתעשייה הם כדלקמן.
- מטלורגיה (לריתוך וחיתוך מתכות).
- רפואה.
- חקלאות.
- כמו דלק טילים.
- סינתזה של חומרים כימיים רבים, כולל חומרי נפץ.
- טיהור וחיטוי מים.
קשה לנקוב אפילו בתהליך אחד שבו זה גז גדול, חומר ייחודי - חמצן לא לקחת חלק.
</ p>